
NOVAS ÁREAS DE ATUAÇÃO MÉDICAS.
12/04/2023
NOVO CONSENSO INTERNACIONAL DE CÂNCER DE MAMA
14/04/2023
Uma paciente portadora de HIV que necessitou de transplante de células sanguíneas de cordão combinadas com células-tronco haploidênticas para tratar leucemia mielóide aguda apresentou aviremia na ausência de terapia antirretroviral para HIV.
Resumo
Após a cura anterior de dois homens de HIV-1 por meio de procedimentos de transplante halogênico de células-tronco, um estudo relata uma aplicação mais ampla dessa abordagem, demonstrando a primeira cura possível em uma mulher mestiça usando CCR5D32/D32 transplante de haplocord para tratar leucemia mieloide aguda. Esse transplante resultou em resistência a cepas de HIV e nenhum vírus detectável foi observado mesmo com a remoção dos medicamentos antirretrovirais.
Introdução
Em todo o mundo, quase 38 milhões de pessoas vivem com o HIV-1 (PLWH), sendo cerca de 1,2 milhão nos Estados Unidos. A infecção pelo HIV-1 é incurável devido ao estabelecimento precoce da latência do HIV-1 em células T CD4+ de memória em repouso e de longa duração. Esses provírus latentes alimentam a viremia quando a terapia antirretroviral (ART) é interrompida, exigindo tratamento vitalício. CCR5, um gene receptor de β-quimiocina, é o principal co-receptor usado pelo HIV-1 para infectar as células T CD4+. Uma mutação de deslocamento de quadro CCR5Δ32 homozigótica que deleta 32 pares de bases (CCR5Δ32/Δ32) na região codificadora elimina a expressão da superfície celular do CCR5. Essa mudança confere resistência natural a variantes do HIV-1 tropismos para o CCR5. Cerca de 10% dos europeus do norte brancos carregam a mutação Δ32 em CCR5; no entanto, apenas 1% são homozigotos para a mutação. O transplante com células-tronco CCR5Δ32/Δ32 poderia erradicar os reservatórios de HIV-1, substituindo um sistema imunológico por um resistente ao HIV-1, resultando em remissão e cura do HIV-1 para PLWH que precisam de transplante para condições médicas subjacentes. Dois casos publicados de cura do HIV-1 foram relatados usando doadores adultos de células-tronco CCR5Δ32/Δ32 não relacionados.
• O paciente de Berlim: Timothy Brown era um homem branco vivendo com HIV-1 e leucemia mieloide aguda (AML). Ele recebeu um transplante de células-tronco de doador adulto CCR5Δ32/Δ32 não relacionado com antígenos linfócitos humanos (HLA) combinados em 10/10. Após a recidiva da AML, ele recebeu um segundo transplante do mesmo doador. Ele foi considerado curado do HIV-1 e da AML. Ele morreu 12 anos depois de uma recidiva da AML sem evidência de recidiva do HIV-1 fora do ART.
• O paciente de Londres: Adam Castillejo recebeu um transplante de células-tronco de doador adulto CCR5Δ32/Δ32 não relacionado com HLA combinados em 9/10 para o seu linfoma de Hodgkin. Ele foi relatado em remissão após 18 meses de aviremia fora do ART e curado após 30 meses sem recidiva de viremia do HIV-1. Além disso, o paciente de Duesseldorf, um homem vivendo com HIV-1, que também recebeu um transplante de células-tronco adulto CCR5Δ32/Δ32 para AML, teve 6 meses de aviremia após interrupção do tratamento antirretroviral (ATI). No momento deste relatório, não há informações atualizadas publicadas
Resultados
O IMPAACT P1107 foi um estudo observacional projetado para incluir indivíduos com mais de 12 meses de idade até a idade adulta vivendo com HIV-1 que precisam de um transplante de células-tronco halogênicas para doenças subjacentes, como malignidades hematológicas. O estudo utilizou unidades de sangue de cordão umbilical (CBUs) pré-selecionadas para o alelo CCR5Δ32 para heterozigotos e homozigotos da StemCyte, uma combinação de bancos privados e públicos de CBUs, como uma estratégia para levar à cura da condição subjacente e do HIV-1 simultaneamente.31 Na época do desenvolvimento do estudo em 2013, a StemCyte havia examinado 18.000 CBUs e identificado 171 unidades homozigotas CCR5Δ32/Δ32;31 agora, tem mais de 300 unidades de sangue de cordão homozigotas. O estudo foi co-endossado pelo Grupo de Ensaios Clínicos sobre AIDS patrocinado pelo NIH (ACTG) para inscrever participantes adultos e pelo Centro Internacional de Transplante de Sangue e Medula Óssea (CIBMTR) para recuperar dados clínicos e laboratoriais coletados para transplantes de células-tronco nos Estados Unidos. Dois participantes foram inscritos no IMPAACT P1107. O primeiro foi um homem de meia-idade vivendo com HIV-1 que desenvolveu linfoma de Hodgkin e passou por um transplante haplo-cord com CBU CCR5Δ32/Δ32. Ele sucumbiu a um linfoma de Hodgkin redicivante após perder o enxerto do doador de CBU CCR5Δ32/Δ32 em um ano após o transplante. Ele não teve avaliações do reservatório entre o transplante e a recidiva do linfoma. No entanto, detectamos DNA do HIV-1 (11,1 cópias/mL) após o transplante por até 51 semanas e viremia de baixo nível detectável em 1,3 cópias/mL de RNA do HIV-1 enquanto permanecia indetectável por ensaio clínico <20 cópias/mL, confirmando a persistência de células produtoras de HIV-1. A segunda participante, uma mulher, é descrita abaixo.
Caso de estudo: Uma mulher foi diagnosticada com infecção aguda pelo HIV-1 4 anos antes de um diagnóstico de LMA. A paciente se identificou como de raça mista. No momento do diagnóstico do HIV-1, sua carga viral plasmática (CV) estava acima do limite superior de quantificação em >1.000.000 cópias/mL de RNA do HIV-1.
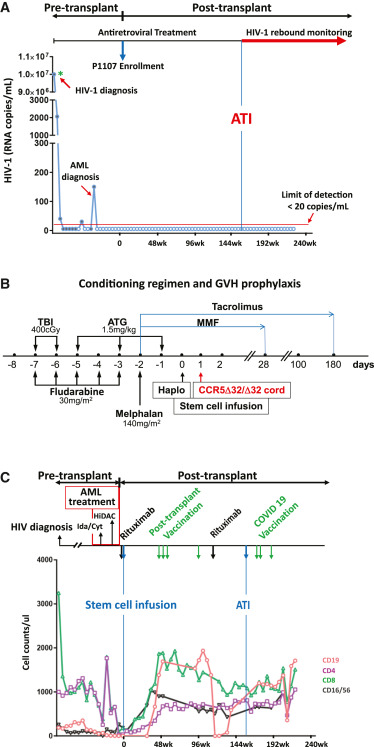
Ela foi tratada durante a infecção aguda pelo HIV-1 com tenofovir fumarato de disoproxil/emtricitabina e raltegravir. o tratamento dela durante a infecção aguda é relevante, dado o conhecido impacto da TARV precoce na persistência do HIV-1.35,36No entanto, nosso participante tinha um reservatório latente de HIV-1 detectado antes do transplante em 1,38 unidades infecciosas por milhão (IUPM), em níveis observados em adultos durante a infecção crônica.4,37Após 5 meses de TARV, sua CV caiu para níveis abaixo dos limites de quantificação de ensaios clínicos (<20 cópias de HIV-1 RNA/mL). Ao longo de seu curso de infecção pelo HIV-1, ela teve várias mudanças em seu regime de ART: nenhuma por falha virológica. Estes incluíram uma mudança para um regime contendo rilpivirina (tenofovir alafenamida/emtricitabina/rilpivirina), seguido por um regime contendo dolutegravir (abacavir/lamivudina/dolutegravir) e, finalmente, tenofovir alafenamida/emtricitabina/bictegravir. Ela manteve o controle da viremia plasmática, exceto por um episódio de viremia transitória para 30 cópias de RNA do HIV-1/mL quando sua ART foi brevemente suspensa para neutropenia e antes de ser finalmente diagnosticada com LMA.
Quatro anos após o diagnóstico de infecção aguda pelo HIV-1, ela foi diagnosticada com LMA de alto risco com anomalia citogenética de monossomia 7. Ela recebeu quimioterapia de indução padrão com idarubicina e citarabina, após o que ela obteve remissão morfológica e citogenética. Ela também recebeu um ciclo de consolidação com citarabina em alta dose. Durante a quimioterapia de indução, ela teve viremia de baixo nível transitória de até 150 cópias/mL de RNA do HIV-1, indicando a persistência de células produtoras de HIV-1 sob TARV (Figura 1A).
Procuramos no registro da StemCyte e identificamos cinco CBUs mutados compatíveis com CCR5Δ32/Δ32 com uma correspondência de HLA de 4/8 ou superior. Também identificamos um doador adulto haploidentico relacionado com alelo selvagem CCR5 para apoiar um transplante de haplo-corda com enxerto inicial transitório. Em 2017, ela foi submetida a um transplante de haplo-corda, que consistiu em células selecionadas CD34 do sangue periférico do doador adulto haploidentico, seguido pelo CBU CCR5Δ32/Δ32 com correspondência de HLA 5/8. O enxerto de sangue do cordão umbilical continha 2 x 10^7 células nucleadas por kg e 2,2 x 10^5 células CD34 por kg do peso do receptor. O regime de condicionamento do transplante incluiu fludarabina, melphalan, irradiação corporal total (4 Gray) e globulina antitimócito (ATG). A profilaxia da doença do enxerto contra o hospedeiro (DECH) consistiu de micofenolato de mofetil por 28 dias e tacrolimo até o dia 180 (Figura 1B). Antes de receber o regime de condicionamento, ela recebeu uma dose de rituximab para profilaxia contra a doença linfoproliferativa pós-transplante associada ao vírus Epstein-Barr (EBV). Sua evolução hospitalar inicial foi tranquila, com enxerto de neutrófilos e plaquetas aos dias 16 e 10, respectivamente. Ela recebeu alta hospitalar no dia +17 pós-transplante. Duas semanas após o transplante, 82% de suas linhagens linfoides (células CD3+) e 98% das linhagens mieloides (células CD33+) eram do doador adulto haploidentico. Aos 14 semanas, houve enxerto de 100% com o CBU CCR5Δ32/Δ32 para ambas as linhagens (Figura 2). Seis meses após o transplante, as células B (células CD19+) retornaram aos níveis normais e, aos 13 meses, os subconjuntos de células T CD4 e CD8 e as células NK (CD16 e CD56) mostraram recuperação para níveis normais e permaneceram.

O curso pós-transplante do participante foi marcado por citomegalovírus (CMV) viremia assintomática 2 meses após o transplante com pico de 1.374 cópias/mL de DNA, para o qual ela recebeu um curso de valganciclovir oral. Vinte e oito meses após o transplante, ela teve reativação assintomática do vírus Epstein-Barr (EBV) com pico de 26.885 cópias/mL, para o qual ela recebeu uma dose de rituximabe, resolvendo sua viremia por EBV. Os linfócitos B normalizaram-se 5 meses após o tratamento com rituximabe (Figura 1C).
Durante os primeiros 2 anos após o transplante, nossa participante teve vários episódios documentados de infecções leves do trato respiratório superior com adenovírus, rinovírus, coronavírus não-SARS-CoV-2 e vírus sincicial respiratório. Ela permaneceu avirêmica para HIV-1 durante todo o período pós-transplante, com e sem TAR. Ela não desenvolveu GVHD aguda ou crônica. A biópsia de medula óssea 4 anos após o transplante mostrou remissão contínua de LMA. Ela permanece em remissão de LMA 55 meses após o transplante com quimerismo de 100% para as células do doador do cordão CCR5Δ32/Δ32 (Figura 2).
Durante mais de 55 meses de acompanhamento pós-transplante, todos os testes laboratoriais clínicos mostraram níveis indetectáveis de RNA do HIV, incluindo RNA do HIV-1 indetectável no líquido cefalorraquidiano, usando um ensaio padrão com um limite de quantificação de 20 cópias/mL. Notavelmente, detectamos traços de RNA do HIV-1 de baixo nível pelo ensaio de cópia única no plasma em um único momento 107 semanas após o transplante, mas isso não significou uma recidiva iminente, já que testes subsequentes não encontraram RNA do HIV-1. Consulte a seção Métodos STAR para obter mais informações sobre testes de marcadores de reservatório e persistência do HIV-1.
Após aconselhamento e discussão, o participante do estudo optou por interromper seu regime TAR aos 30 meses pós-transplante para avaliar a remissão do HIV-1 e possível cura. A primeira interrupção do ART durou apenas 13 dias, já que a pandemia inicial de COVID-19 aumentou a preocupação com a capacidade de realizar o monitoramento frequente necessário para recidiva viral fora do TAR. Aos 37 meses pós-transplante, o ART foi interrompido novamente (Figura 1A). Os níveis de RNA do HIV-1 permaneceram indetectáveis em <20 cópias/mL sem alvo detectado por 18 meses após ATI (Figura 1A), anunciando a remissão do HIV-1 e uma possível cura do HIV-1.
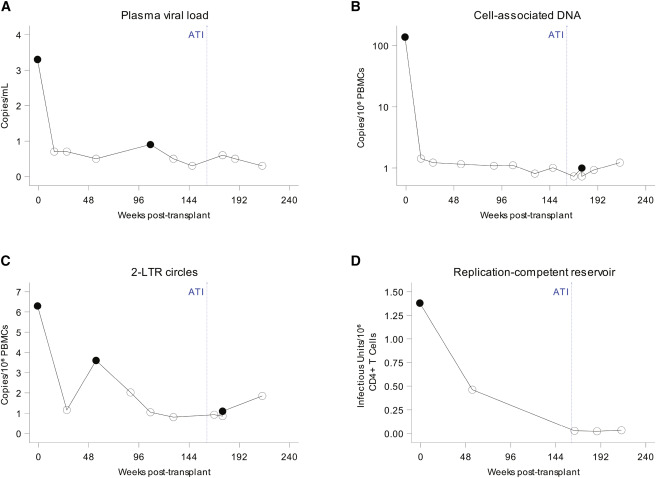
Uma vez que o participante parou de receber a terapia antirretroviral (TAR), amostramos um total de 74,5 milhões de células CD4+ T das semanas 3 a 53 e não encontramos nenhum surto viral, ou seja, nenhum reservatório viral latente competente para replicação. O tamanho cumulativo estimado do reservatório latente pós-transplante foi ≤0,009 IUPM, refletindo uma redução mínima de 153 vezes no tamanho do reservatório latente (Figura 3D).
Após o transplante, o DNA do HIV-1 e o RNA do HIV-1 no plasma foram essencialmente indetectáveis e permaneceram assim até 147 semanas pós-transplante, quando usamos um ensaio de cópia única42. No entanto, detectamos traços transitórios de DNA do HIV-1 em círculos de 2-LTR, estimados em 1,10 cópias/106 milhões de PBMCs em análises de equivalentes celulares de 1,23 milhão de PBMCs em um único ponto de tempo 176 semanas após o transplante, coincidindo com 15 semanas após a interrupção da TAR. Novos testes em outra alíquota de PBMCs do mesmo ponto de tempo também mostraram DNA do HIV-1 a 1,1 cópias por milhão de PBMCs. Detectamos um único episódio de viremia de baixo nível no limite de quantificação do ensaio de cópia única, em 0,9 cópias de RNA do HIV-1/mL, 107 semanas após o transplante (Figura 3A). No entanto, o significado clínico dessas observações é incerto e exigirá acompanhamento adicional para compreensão de suas implicações.
Exceto por esses dois pontos de tempo, todos os pontos de tempo testados após a interrupção da TAR, incluindo medula óssea e células CD4+ T purificadas, foram negativos para DNA e RNA do HIV-1. No ponto de tempo de 55 semanas pós-transplante, o tamanho do reservatório latente foi estimado em <0,46 IUPM de células CD4+ T, embora apenas 1,5 milhão de células CD4+ T estivessem disponíveis para análise naquele momento.
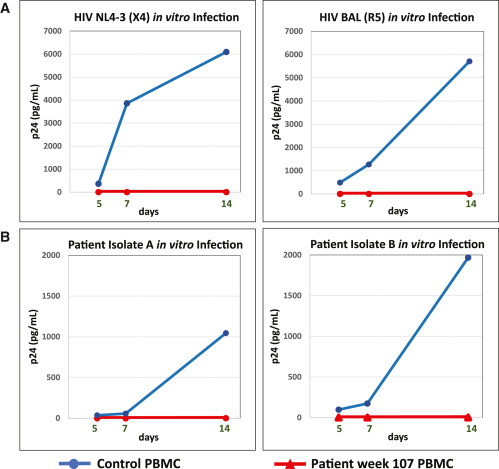
Análises do pool proviral pré-transplante mostraram que o HIV-1 do paciente era tropismo CCR5, sem detecção de HIV-1 tropismo CXCR4. Testamos as células PBMC do doador enxertado do cordão umbilical a partir de 27 meses pós-transplante, juntamente com as células PBMC do doador normal, para verificar sua suscetibilidade à infecção pelos dois clones autólogos do reservatório latente recuperados antes do transplante, juntamente com cepas laboratoriais R5-tropic (HIV-1 BAL) e X4-tropic (NL-4-3). O CBU enxertado CCR5Δ32/Δ32 mostrou resistência intrínseca a ambos os clones autólogos do reservatório latente e às cepas laboratoriais R5 e X4. Os PBMCs do doador de controle apresentaram cinética de replicação normal para todos os isolados testados (Figura 4).
A medição dos níveis de drogas antivirais fornece informações objetivas sobre a aderência que ajudam a monitorar a adesão dos pacientes aos medicamentos antirretrovirais. Para garantir que nosso participante não estivesse tomando antirretrovirais durante o período pós-ATI, medimos amostras de plasma coletadas em intervalos pós-transplante enquanto estava em TARV e pós-ATI. Encontramos níveis detectáveis de TARVs no plasma antes da ATI, mas nenhum em qualquer amostra durante os 18 meses sem TARV.
Imunologia
O participante apresentou reconstituição imunológica de células T, perda de marcadores de ativação imunológica e respostas imunes à vacina. Coincidente com a aviremia fora do TARV, monitoramos biomarcadores imunológicos associados à infecção pelo HIV-1. As células T do CBU são predominantemente ingênuas.43,44,45 O reservatório para HIV-1 reside principalmente em células T CD4 + de memória6,46,47,48,49 e (em adultos) em grande parte em células T CD4 + de memória central.49 Analisamos os fenótipos dos CBU enxertados para células T ingênuas (TN), efetoras (TE), memória central (TCM) e memória efetora (TEM). Do dia 100 até 161 semanas pós-transplante (pouco antes da interrupção da TARV), as frequências de CD4 + TN aumentaram e as células T de memória diminuíram. A mudança das células T foi mais evidente em TCM do que em TEM, com níveis flutuantes de TE (Figura S1A). Da mesma forma, as frequências de CD8 + TN aumentaram com uma diminuição coincidente em CD8 TCM e níveis igualmente flutuantes de TEM e TE. Assim, o fenótipo das células imunes pós-transplante neste receptor se assemelhou à imunidade desenvolvimental50,51 e permaneceu estável após ATI.

Uma característica da infecção pelo HIV-1 é um alto nível de ativação imunológica, manifestando-se como níveis aumentados de linfócitos T CD4+ e CD8+ ativados que não são completamente revertidos com as estratégias atuais de tratamento antirretroviral.52,53,54 Aproximadamente 100 dias (semana 15) pós-transplante, o primeiro ponto de tempo estudado, os níveis de ativação imunológica eram elevados em ambos os subconjuntos de células T CD4+ (13,6%) e CD8+ (19,4%). As frequências de células T imunologicamente ativadas diminuíram para 1,54% e 3,97% em 76 semanas pós-transplante. Elas permaneceram baixas em 1,2% e 3,6% para células T CD4+ e CD8+, respectivamente, até a semana 170 pós-transplante e pré-ATI e em 52 semanas pós-ATI, consistente com a ausência de replicação ativa do HIV-1 (Figura S1B).
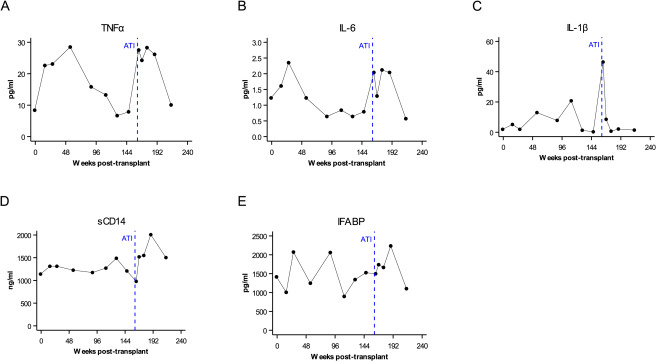
Para investigar os biomarcadores solúveis de inflamação, avaliamos os níveis dos citocinas TNFα, IL-6, IL-1β, marcador de ativação de monócitos (sCD14) e proteína de ligação de ácido graxo intestinal de translocação microbiana intestinal (I-FABP) pós-transplante e após ATI (Figura S2). Pós-transplante, os níveis de TNFα, IL-1β, I-FABP e IL-6 aumentaram e atingiram o pico em 26 semanas antes de retornarem aos níveis pré-transplante em 156 semanas, consistentes com a inflamação prolongada conhecida pós-transplante. Curiosamente, houve um aumento nesses níveis de citocinas pró-inflamatórias novamente pré-ATI e diminuíram para níveis basais em 52 semanas pós-ATI (o marcador de ativação de monócitos sCD14 foi inicialmente elevado, depois diminuiu em 130 semanas pós-transplante e permaneceu baixo pós-ATI).
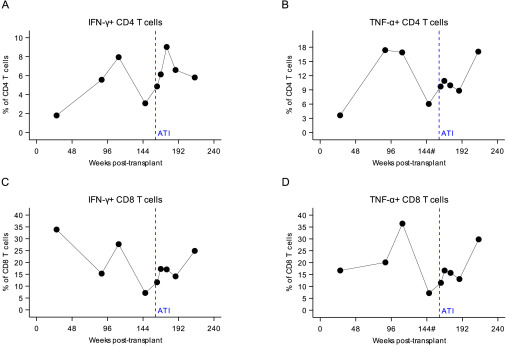
Para investigar ainda mais a reconstituição imune, examinamos a capacidade funcional do CBU enxertado em vários momentos após o transplante (26, 78, 104, 148, 156 e 170 semanas) e após o ATI (4, 12, 26 e 52 semanas). Observamos a produção de citocinas intracelulares interferon-gama (IFN-γ) e fator de necrose tumoral-alfa (TNF-α) em resposta à estimulação por toxina estafilocócica enterotoxina B (SEB) policlonal (Figura S3). Não detectamos respostas de citocinas intracelulares à estimulação específica de antígeno HIV-1-Gag nos subconjuntos de células T CD4+ ou CD8+, indicando a ausência de células T de memória específicas para HIV-1. Não avaliamos especificamente as respostas de células T específicas para CMV ou EBV.
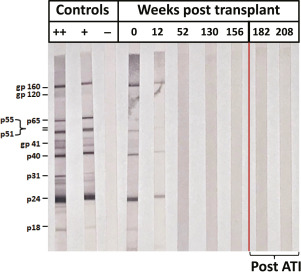
Nosso participante perdeu as respostas humorais específicas do HIV-1 ao longo do tempo, uma característica única em comparação com os pacientes de Berlim e Londres. Quando diagnosticada com HIV-1, ela apresentou reatividade positiva ao gp160, p31 e p18 do HIV-1, e reatividade indeterminada ao gp40 e p24 por western blot. Pré-transplante e aos 100 dias após o transplante, a análise mostrou evidências de respostas de anticorpos específicos do HIV-1 para cinco das 10 proteínas (Figura 5). No entanto, aos 52 semanas após o transplante, houve uma perda completa da reatividade de anticorpos do HIV-1 para todas as 10 proteínas testadas, que permaneceram negativas por 12 meses após a interrupção da terapia antirretroviral.
Após o transplante, nossa participante recebeu uma série de vacinas, incluindo a vacina pneumocócica PCV13, tétano/difteria/coqueluche (TDaP), haemophilus influenzae tipo B e vacina inativada contra a poliomielite. Ela também recebeu um reforço da vacina pneumocócica (PPSV23) e das vacinas contra sarampo, caxumba e rubéola (MMR). Ela foi imunizada com as vacinas de mRNA do SARS-CoV-2 nas semanas 189 e 193 após o transplante (Figura 1B; Tabela S1). As respostas de anticorpos induzidos pela vacina para o tétano, poliovírus, pneumococos selecionados, sarampo e vacinas contra rubéola indicaram um sistema imunológico funcional. Além disso, foram detectados anticorpos anti-spike para a nova vacina de mRNA do SARS-CoV-2, apoiando a presença de um sistema imunológico intacto (Tabela S1).
Fonte: Artigos científicos CELL





